Abberior Pulsed STED Technology
Pulsed STED 超分辨, 是尖端, 稳定, 易使用的STED直接光学超分辨系统, 此技术是基于共聚焦扫描, 直接纯光学的超分辨,去除费时的随机重构.Pulsed STED超分辨搭载智能光照 (Adaptive Illumination) 可落实应用在超长时间的活细胞4D超分辨成像应用, 真正有效避免荧光淬灭漂白, 光毒性. 真正实时超长时间的活细胞 3D-4D超分辨荧光成像, 获取超威结构落实有意义的实验结果
详细介绍

受激发射损耗超分辨技术
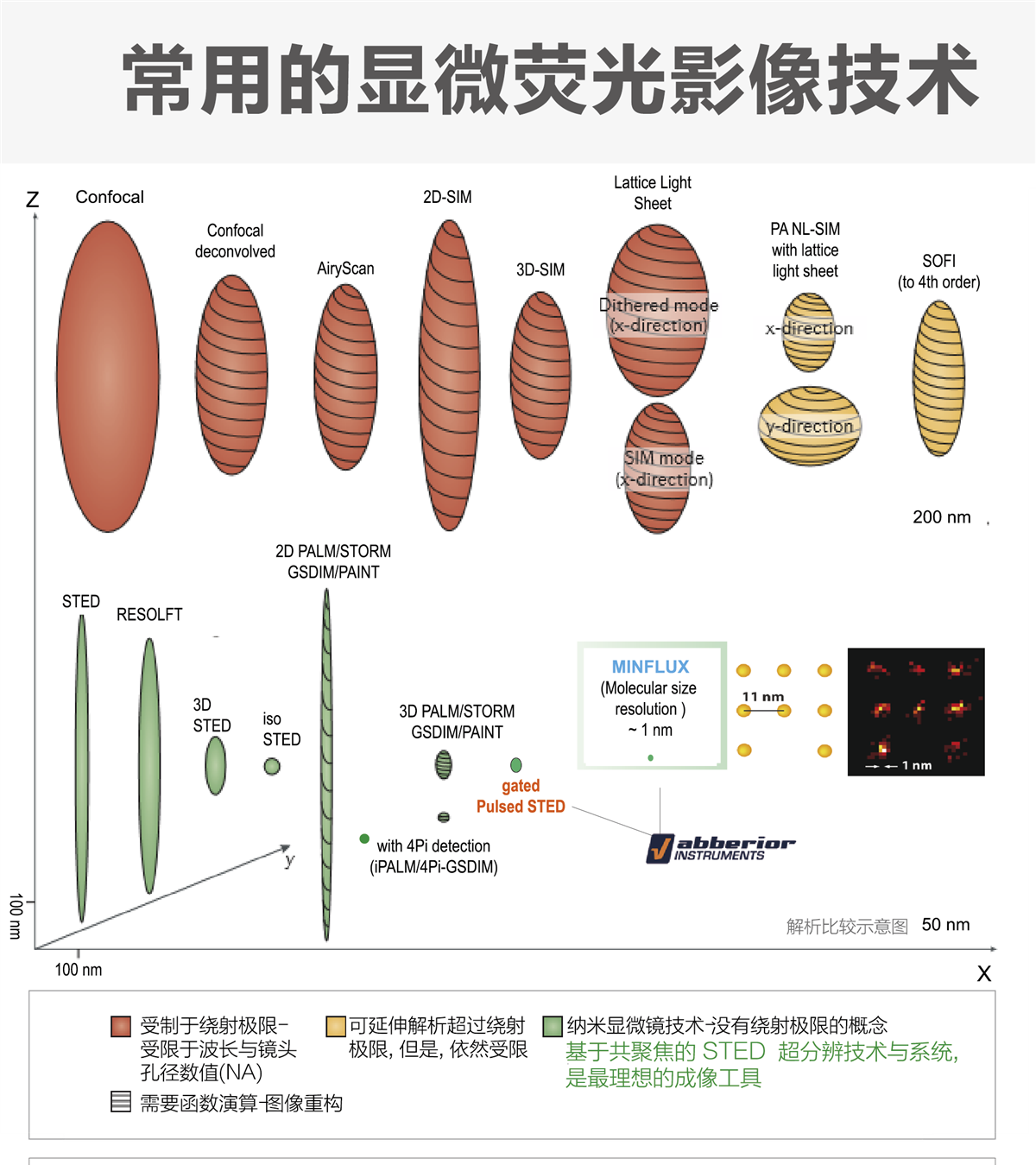
Stimulated Emission Depletion Microscopy (STED)
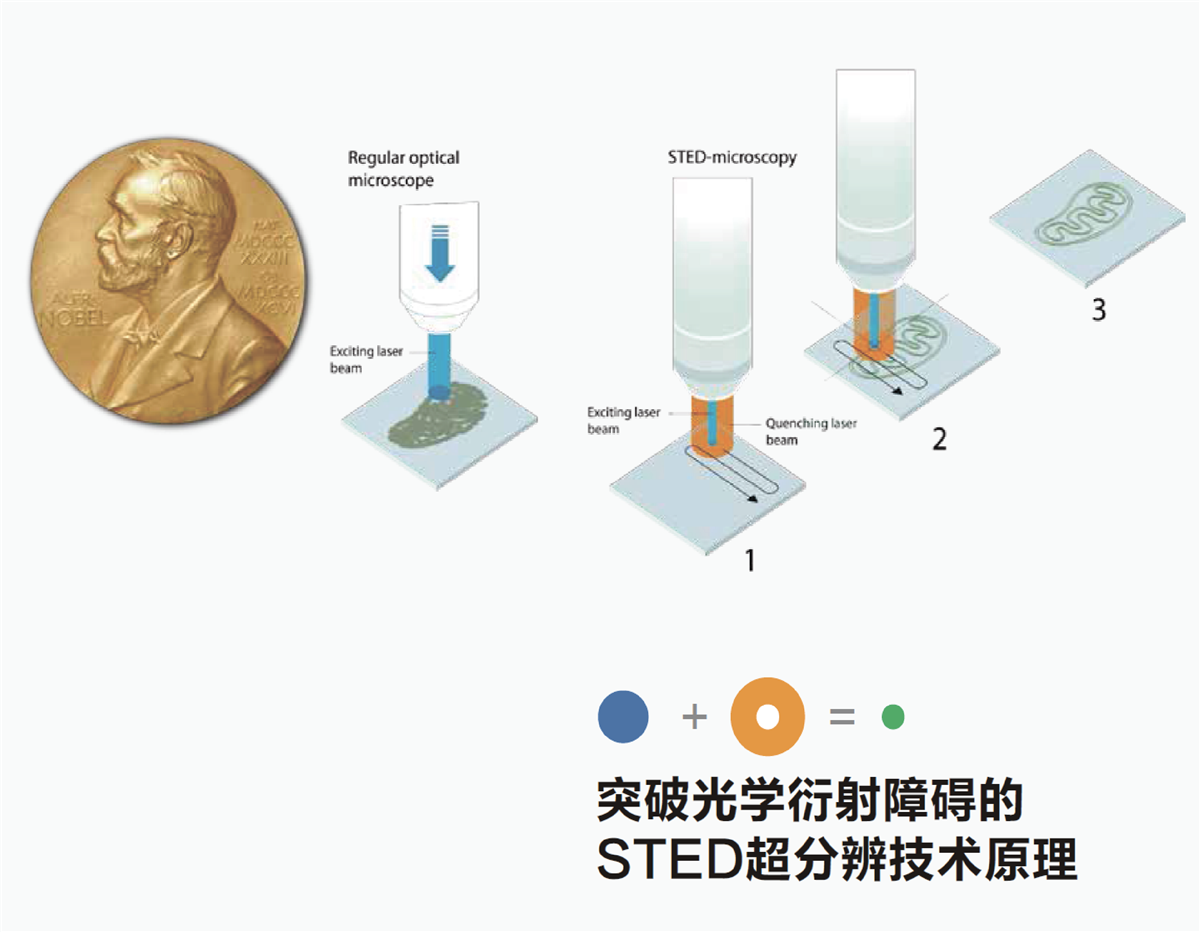
STED 超分辨显微镜技术是由德国 Stefan Hell (2014 年诺贝尔奖得主) 发明.此技术隶属超分辨纳米荧光成像, 突破阿贝 (ABBE) 光学衍射的障碍 ( 200 nm ).
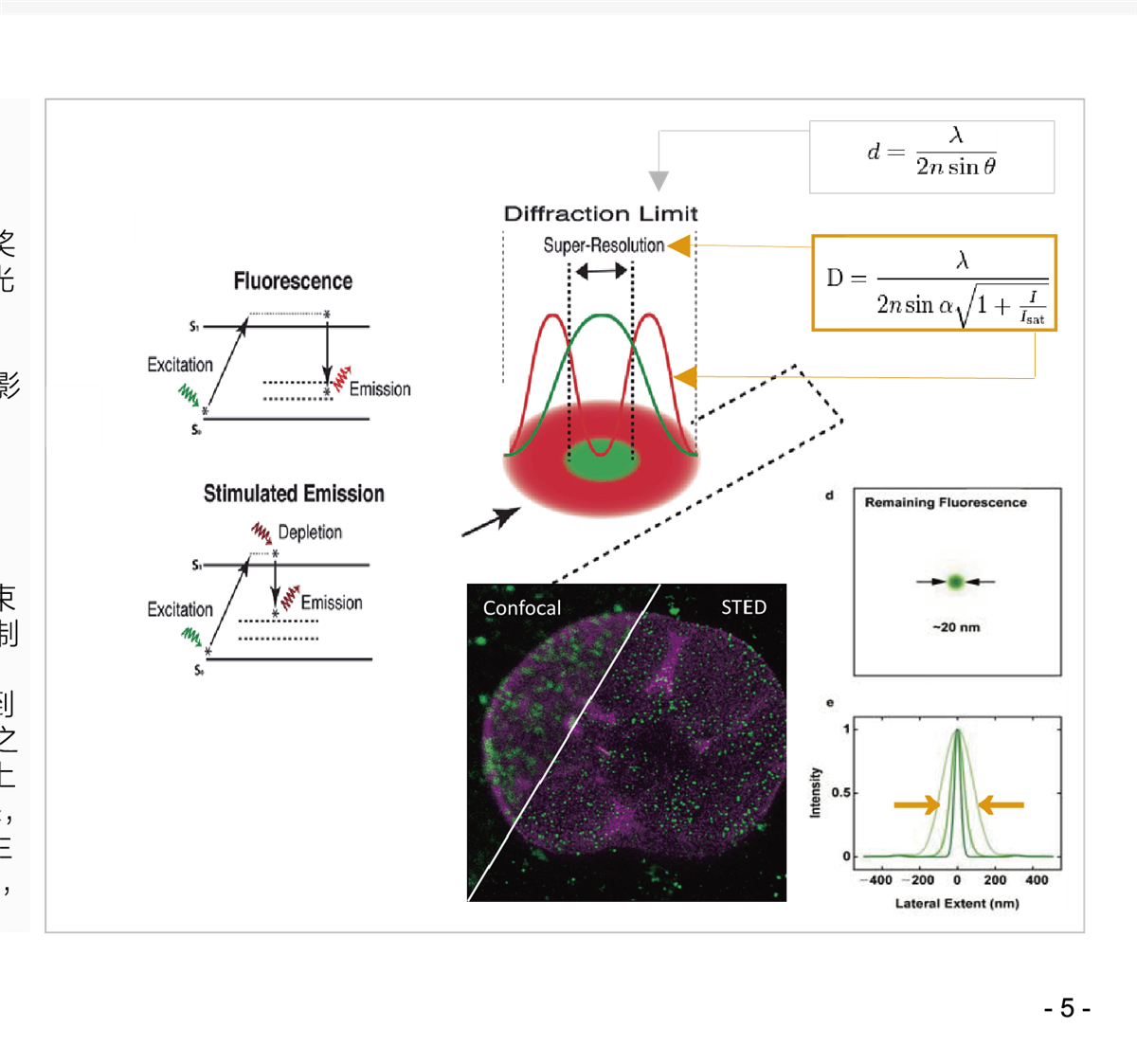
STED 技术的基本概念,主要是限制荧光产生的范围,进而提高影像分辨率. 这个提升分辨率的方式取决于可产生荧光的区域大小,所以并不受Abbe 理论所限制.
通过共聚焦实现点扫描方法, 精确知道分子目标的定位.
在共聚焦的扫描光束上, 透过另一道 STED激光 (迭加在激发光束上, 类似“甜甜圈状” 的环形激光, 一般 STED 光束会经空间调制器(spatial light modulator)或 相位板(votex phase plate)调制后,形成环状强度分布(甜甜圈状)并与激发光点重迭以得到均匀对称的点扩散函数。), 随后照射于样品上, 使处于激发态之分子产生受激放射. 在 STED 光束作用下,原本激发光点的周围上处于激发态之荧光分子,会透过 受激放射将能量释出并回到基态,仅允许STED光束中心强度为零的区域产生荧光。
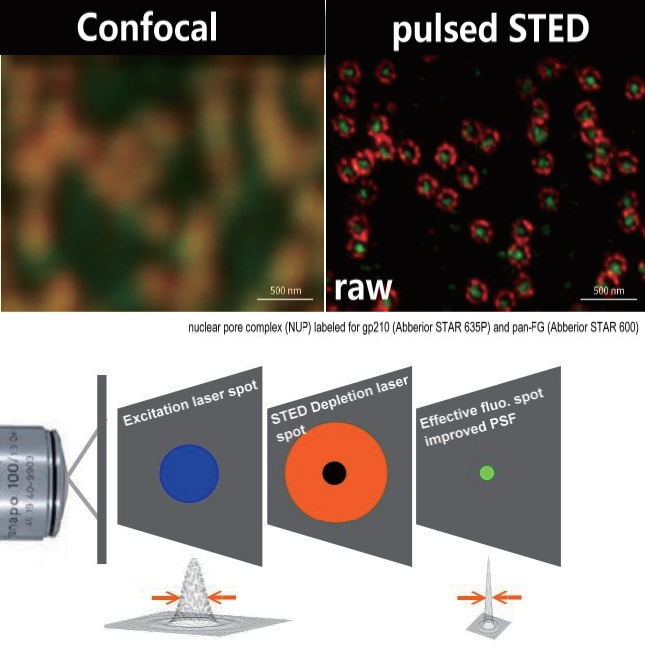
同时,因为产生受激放射效率与光强度成正比, 所以只要提高STED光束的强度,便能有效限制荧光产生的范围并使得到的影像分辨率提高.
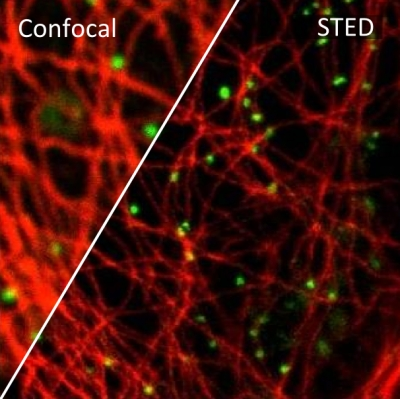
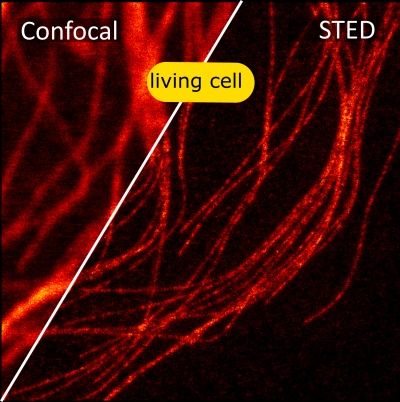
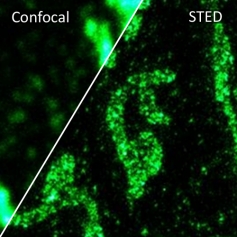
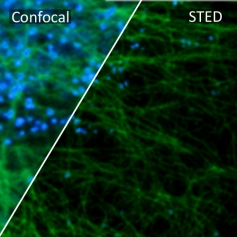
STED 超分辨在神经科学的研究
在培养的海马神经元轴突中, 肌动蛋白形成各种结构, 包括束, 贴片 (参与保护神经元极性), 以及周期性环状结构. 尽管如此,肌动蛋白在神经元和轴突起始区段(AIS)中的重迭组织仍然不清楚,主要是由于缺乏足够的成像方法。 通过利用活细胞受激发射损耗(STED)纳米显微镜和荧光探针 SiR-Actin, 可以显示周期性亚膜肌动蛋白结构实际上存在于轴突和树突中。 周期性细胞骨架组织也在周围神经系统中发现,特别是在Ranvier的节点处. AIS中的肌动蛋白贴片与突触前标记共定位。 细胞溶质肌动蛋白组织强烈依赖于发育阶段和亚细胞定位。 总而言之,STED的超分辨成像结果揭示了独特的神经元细胞骨架特征。
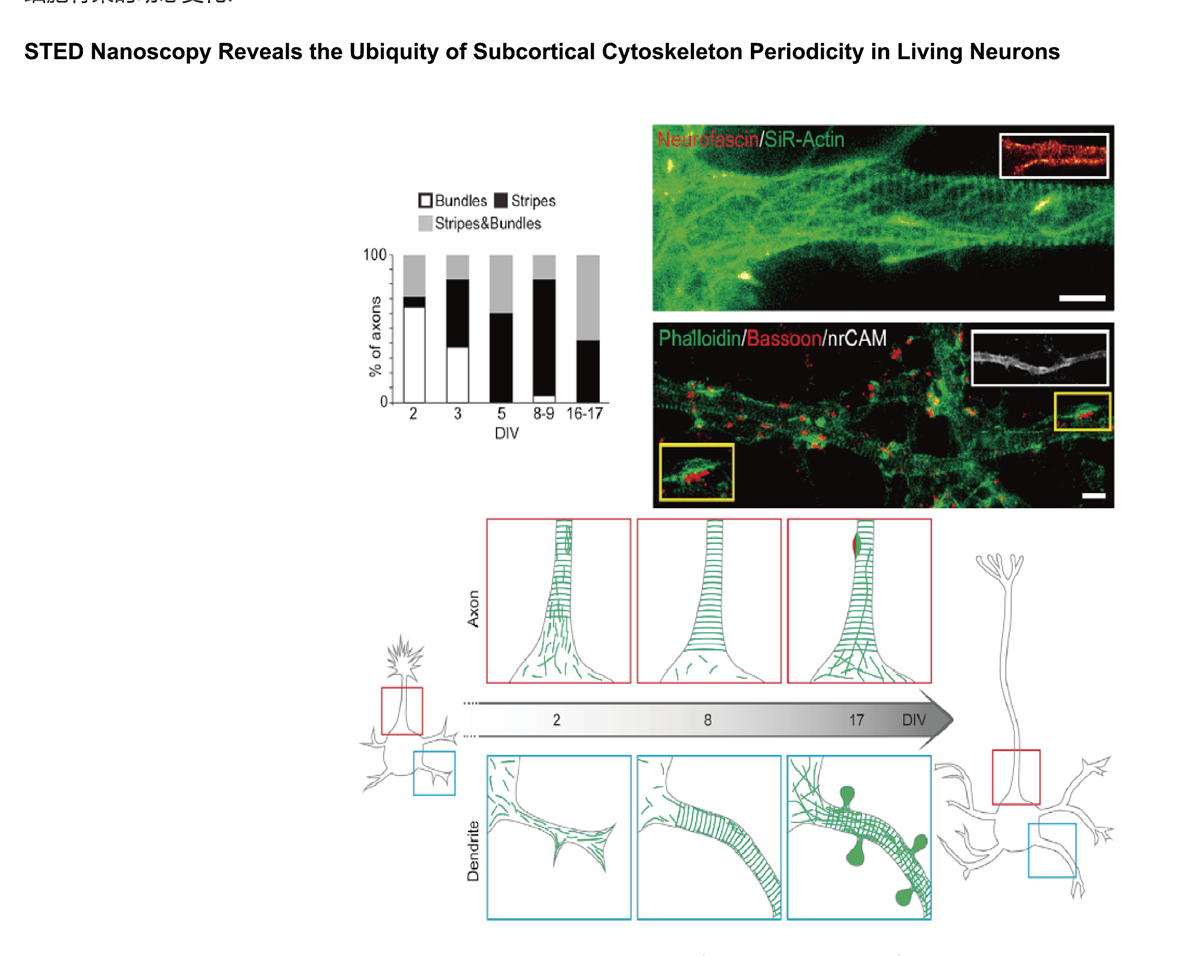
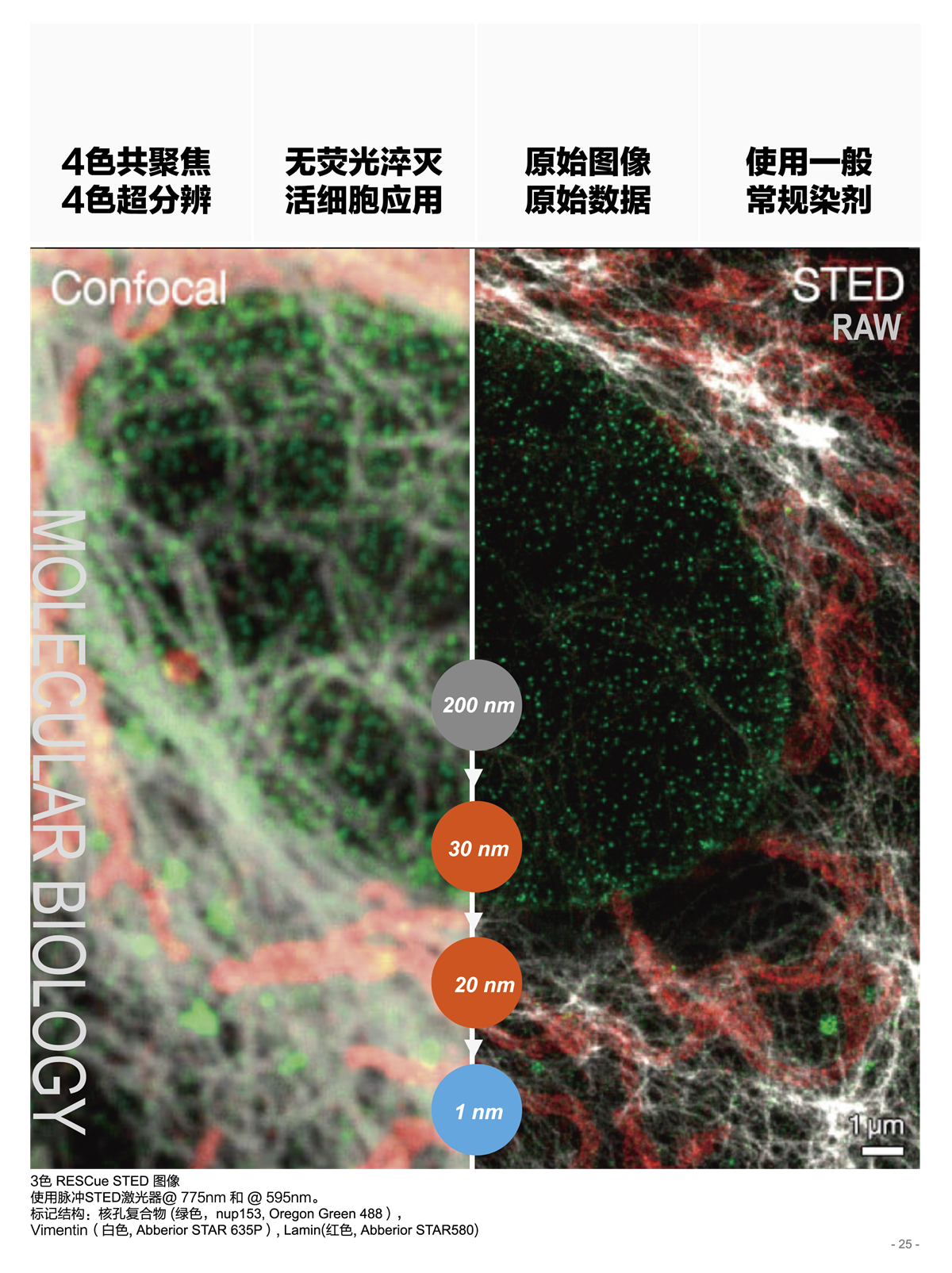
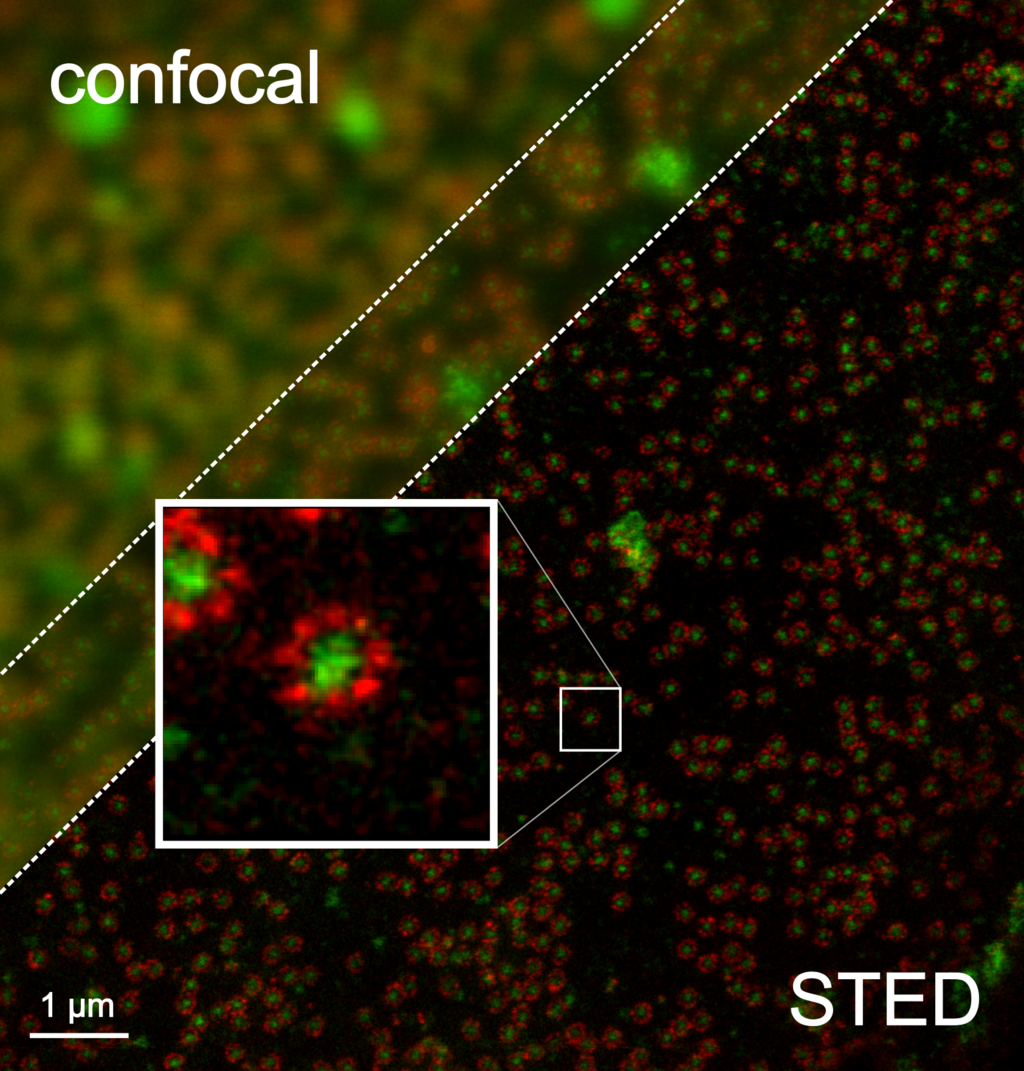
STED 超分辨在分子生物科学的研究